원자 궤도(Orbit)와 오비탈(궤도함수, Orbital)이란?
원자 궤도를 간단히 이야기하면 ‘원자의 핵 주위를 이동하는 전자의 경로’입니다. 마치 우주 공간에서 태양 주위를 공전하는 행성과 비슷한 개념입니다. 원자 오비탈(궤도함수)은 전자가 존재하는 것으로 계산되는 핵 주위의 공간 또는 영역을 뜻하는 말로, 파동함수로 표현되는 개념입니다.따라서 원자 궤도(Orbit)와 오비탈(Orbital)은 서로 다른 의미를 가지기 때문에 주의해서 사용해야 합니다. 아래에서 조금 더 자세히 설명드리겠습니다.
원자 궤도(Orbit) vs 원자 오비탈(궤도함수, Orbital)
원자 궤도
1. 원자 궤도는 핵 주위를 회전하는 전자의 (특정하게 정의된) 원형의 경로로 2차원 운동을 나타냅니다.
2. 원자 궤도는 전자의 명확한 이동 경로를 나타내는 것이기 때문에 불확정성의 원리를 따르지 않습니다.
3. 원자 궤도는 원형이며 방향성이 없습니다.
4. 원자 궤도는 뉴턴의 운동 법칙을 따릅니다. 동일한 각속도를 가지면서 음으로 하전된 전자를 양으로 하전된 핵이 끌어당기기 때문에 원형의 원자 궤도가 만들어집니다
5. 특정한 원자 궤도에는 2n2 개의 전자를 수용할 수 있습니다. (여기서 n은 양자수)
원자 오비탈(궤도함수)
1. 전자를 찾을 확률이 최대인 핵 주위 공간의 영역을 나타냅니다. 원자 궤도와는 달리 핵 주위의 전자의 3 차원 운동을 나타냅니다
2. 원자 오비탈(궤도함수)는 불확정성원리를 따르기 때문에 명확한 원자의 이동 경로를 지정하지 않습니다. 즉, 전자는 원자 오비탈 영역 어느 곳에도 있을 수 있습니다.
3. 원자 오비탈의 모양은 원형이 아니라 다양한 모양으로 존재합니다. 예를 들어, s 오비탈은 구형, p 오비탈은 아령 모양입니다.
4. s 오비탈을 제외하고 다른 모든 오비탈에는 방향성이 있습니다.
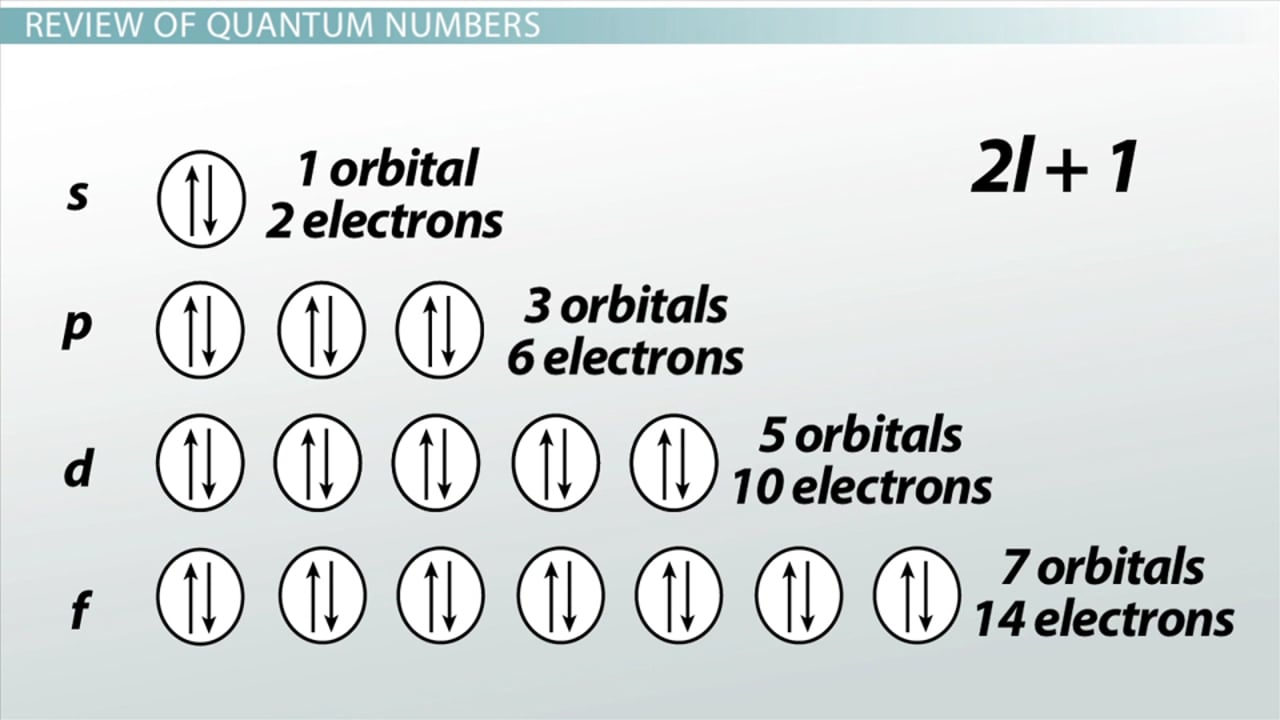
5. 원자 오비탈은 s, p, d 및 f 오비탈로 분류되며 각각의 오비탈에는 최대로 수용 가능한 전자의 수가 2개, 6개, 10개 및 16개 입니다.
원자 오비탈의 모양
원자 오비탈의 모양은 핵 주위에서 전자를 찾을 가능성에 따라 서로 다른 모양의 오비탈을 가집니다. 앞서 말씀드린 것처럼 오비탈은 s, p, d 및 f 오비탈로 분류됩니다. 각 오비탈의 모양을 아래에서 설명드리겠습니다.
s 오비탈
s 오비탈은 핵 주위를 구성하는 구형의 모양을 가집니다. 원자핵에 가장 가까운 1s 오비탈은 주 양자수 n = 1 이고 방위 양자수 l = 0 입니다. 2s 오비탈은 n = 2 이고 l = 0 이며 하나의 노드(전자를 발견할 확률이 0인)를 가집니다. 3s 오비탈은 n = 3 이고 l = 0 이며 두 개의 노드를 포함합니다. 이를 그림으로 표현하면 아래와 같습니다.

s 오비탈은 구형의 대칭성을 가진 오피탈이며 주양자수-1 만큼의 노드를 가진다는 것을 알 수 있습니다.
p 오비탈
p 오비탈의 모양은 아령 모양으로 두 개의 동일한 풍선이 같이 묶인 것처럼 생겼습니다. 두 개의 로브(lobe)는 축선을 따라 서로 떨어져 있으며 방위양자수 l은 1입니다 . n = 1 인 경우 p 오비탈이 없고 s 오비탈 만 있습니다. n = 2이고 l = 1 일 때, 자기양자수 m에 따라 서로 직교하는 3개의 축을 향하는 3개의 p 오비탈이 존재하는데 이 세 종류의 p 오비탈은 각각 px, py, pz로 부릅니다. 각 오비탈에서 전자를 발견할 수 없는 노드 평면은 각각 yz, xz, zy 평면입니다.

d 오비탈
d 오비탈은 주양자수 n=3 이상인 경우에 존재하는 오비탈로, 방위양자수 l=2입니다. 주양자수 n = 3, l = 2인 경우 에서 자기양자수 m = +2, +1, 0, -1 및 -2에 해당하는 총 5개의 d 오비탈이 존재할 수 있습니다. 각 오비탈은 xyz 직교과표계에 대해 xy, yz, zx, x2-y2, z2로 표현할 수 있는제 이 오비탈의 모양은 다음과 같습니다.
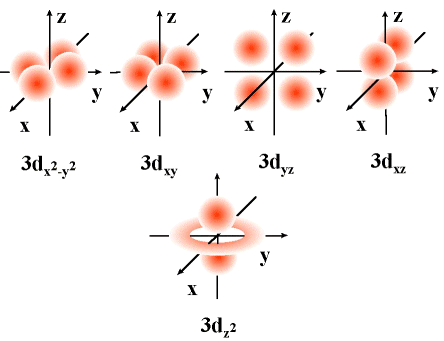
f 오비탈
f 오비탈은 주양자수 n=4 이상의 경우에 존재하며 방위양자수 l=3 입니다. 주양자수 n = 4, 방위양자수 l = 3이면 자기양자수 m = +3, +2, +1, 0, -1, -2 및 -3에 해당하는 총 7개의 d 오비탈이 있을 수 있습니다. 이 f 오비탈의 방향, 이름 및 모양은 다음과 같습니다.

각 오비탈의 전자 분포
s 오비탈
s 오비탈이 가질 수 있는 최대 전자의 수는 주양자수 n에 무관하게 모두 2개입니다. (1s2, 2s2, 3s2 등등) 여기서 각 오비탈에 존재하는 전자의 스핀은 서로 반대입니다.
p 오비탈
각각의 p 오비탈이 가질 수 있는 최대 전자수는 2개이기 때문에는 3 개의 p 오비탈 모두를 고려하면 총 6개의 전자를 가질 수 있습니다. (2p6 또는 2px2 2py2 2pz2)
d 오비탈과 f 오비탈
d 오비탈 및 f 오비탈이 가질 수 있는 총 전자수는 각각 10개와 14개입니다. s, p 오비탈과 마찬가지로 각각의 d 및 f 오비탈에는 서로 스핀이 다른 최대 2개의 전자를 가질 수 있기 때문입니다.
아래의 그림은 각 오비탈에서 최대 전자 분포를 나타내는 모식도입니다.
[원자 구조] 원자 질량과 원자량의 기본 개념
원자 구조 이해를 위한 원자질량, 원자량의 기본 개념에 대하여 고체 상태에서 물질은 원자의 배열 또는 물질을 구성하는 원자나 분자 사이의 상호작용에 따라 다양한 특성을 나타냅니다. 결국
luvlyday.tistory.com
[원자 구조] 원자 반지름의 측정 방법
원자 반지름(Atomic radius)의 정의는? 원자 반지름은 원자의 크기를 나타내는 개념입니다. 원자 반지름은 원자핵에서 원자핵 주위에 존재하는 전자까지의 거리를 측정하면 구할 수 있다고 생각할 �
luvlyday.tistory.com
'화학' 카테고리의 다른 글
| 전자친화도(Electron Affinity)의 뜻과 개념 (1) | 2020.04.21 |
|---|---|
| [원자 구조] 원자 반지름의 측정 방법 (0) | 2020.03.17 |
| 차아염소산나트륨(NaClO)의 특성과 사용법 (0) | 2020.03.04 |
| 불산(Hydrofluoric Acid, HF)이 위험한 이유 (0) | 2020.03.01 |
| 독극물 - 비소에서 복어독, 보톡스까지 (0) | 2020.02.24 |

댓글