전기음성도(Electronegativity)의 정의
전기음성도(Electronegativity)는 원자가 전자를 끌어 당기는 경향을 표현하는 화학적 개념입니다. 전기음성도는 원자번호, 그리고 원자가 전자와 핵 사이의 거리에 영향을 받습니다. 말 그대로, 전기음성도가 높을수록 그 원자는 더 많은 전자를 끌어 당깁니다.
전기음성도 개념의 기원

1811년에 옌스 야코브 베르셀리우스(Jöns Jacob Berzelius)라는 스웨덴의 화학자가 공식적으로 전기음성도라는 개념을 확립하고 명명한 것으로 알려져 있습니다. 하지만 그보다 앞서 아보가드로 (Avogadro)를 비롯한 여러 화학자들은 전기음성도에 대해 연구하였습니다.

라이너스 폴링(Linus Pauling)이라는 화학자가 전기음성도를 '폴링 스케일(폴링 척도)'이라는 숫자로 정량화하게 된 후부터 의 전기음성도는 구체적인 비교가 가능해졌습니다. 폴링의 전기음성도 값은 약 0.7에서 3.98 사이의 무 차원 수치로 나타냅니다. 전기음성도의 비교에는 폴링 스케일이 가장 많이 사용되지만 Mulliken 스케일, Allred-Rochow 스케일, Allen 스케일 및 Sanderson 스케일 등을 이용할 수도 있습니다.
전기음성도는 원자의 고유 특성이 아니라 분자 내의 원자의 특성입니다. 따라서 전기음성도는 실제로 원자의 주위 환경에 따라 달라질 수 있지만 대부분의 상황에서는 유사한 특성을 보입니다. 전기음성도에 영향을 미치는 가장 큰 요소로는 원자핵의 전하와 전자의 수, 그리고 전자의 위치입니다.
전기음성도와 화학결합

비극성 공유결합
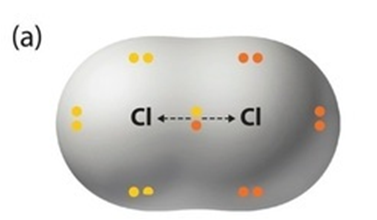
한 분자내에서 동일한 전기음성도를 갖는 2 개의 원자가 함께 결합을 이루면 비극성 결합이 형성됩니다. 이 두 원자는 전기음성도가 같기 때문에 화학결합에 참여한 전자를 동일한 정도로 끌어당기고 전자를 동일하게 공유하며 결합을 이룹니다. 이런 비극성 결합은 동일한 원자로 구성된 분자에서 찾아볼 수 있습니다.
예 : H2, N2, Cl2 등
극성 공유결합
만약 전기음성도가 서로 다른 두 개의 원자가 결합을 이룬다면 극성 결합이 형성됩니다. 더 큰 전기음성도를 갖는 원자는 결합을 이루는 상대원자에서 전자를 더 많이 끌어당기며 극성 공유결합을 형성합니다.
예 : HCl, HF 등

이온 결합
전기음성도 차이가 큰 두 원자가 함께 결합하는 경우에는 극성 결합이 아닌 이온 결합이 형성됩니다. 여기에서 낮은 전기음성도를 가지는 원자의 전자는 높은 전기음성도를 가지는 원자로 전달(transfer)되어 결합을 이룹니다.
예 : NaCl

이온결합과 공유결합의 차이
둘 이상의 원자가 화학결합을 형성하여 서로 연결되면 분자 또는 화합물이 만들어집니다. 이렇게 분자나 화합물이 만들어지는 과정에는 두 종류의 화학결합이 관여하는데, 그 결합은 바로 이온
luvlyday.tistory.com
주기율표와 전기음성도의 관계
주기율표에서 가장 전기음성도가 큰 원소는 불소(F)이며 폴링 스케일 값은 3.98 입니다. 가장 전기음성도가 작은 원소는 세슘(Cs)이며 폴링 스케일 값은 0.79 입니다. 즉, 불소는 가장 전기음성적(전자를 많이 끌어오는)인 원소이며 세슘은 가장 전기양성적(전자를 덜 끌어오는)인 원소라고 말할 수 있습니다. 오래된 몇몇 자료에는 세슘과 프랑슘(Fr)이 가장 낮은 전기음성도(0.7)를 가진 것으로 서술되어 있지만 수정이 필요합니다. 세슘의 폴링 스케일 값은 실험을 통해 0.7이 아닌 0.79로 수정되었습니다만 프랑슘에 대한 실험 데이터는 없는 상황입니다. 다만 프랑슘의 이온화 에너지는 세슘보다 높으므로 프랑슘의 전기음성도는 약간 더 클 것으로 예상됩니다.
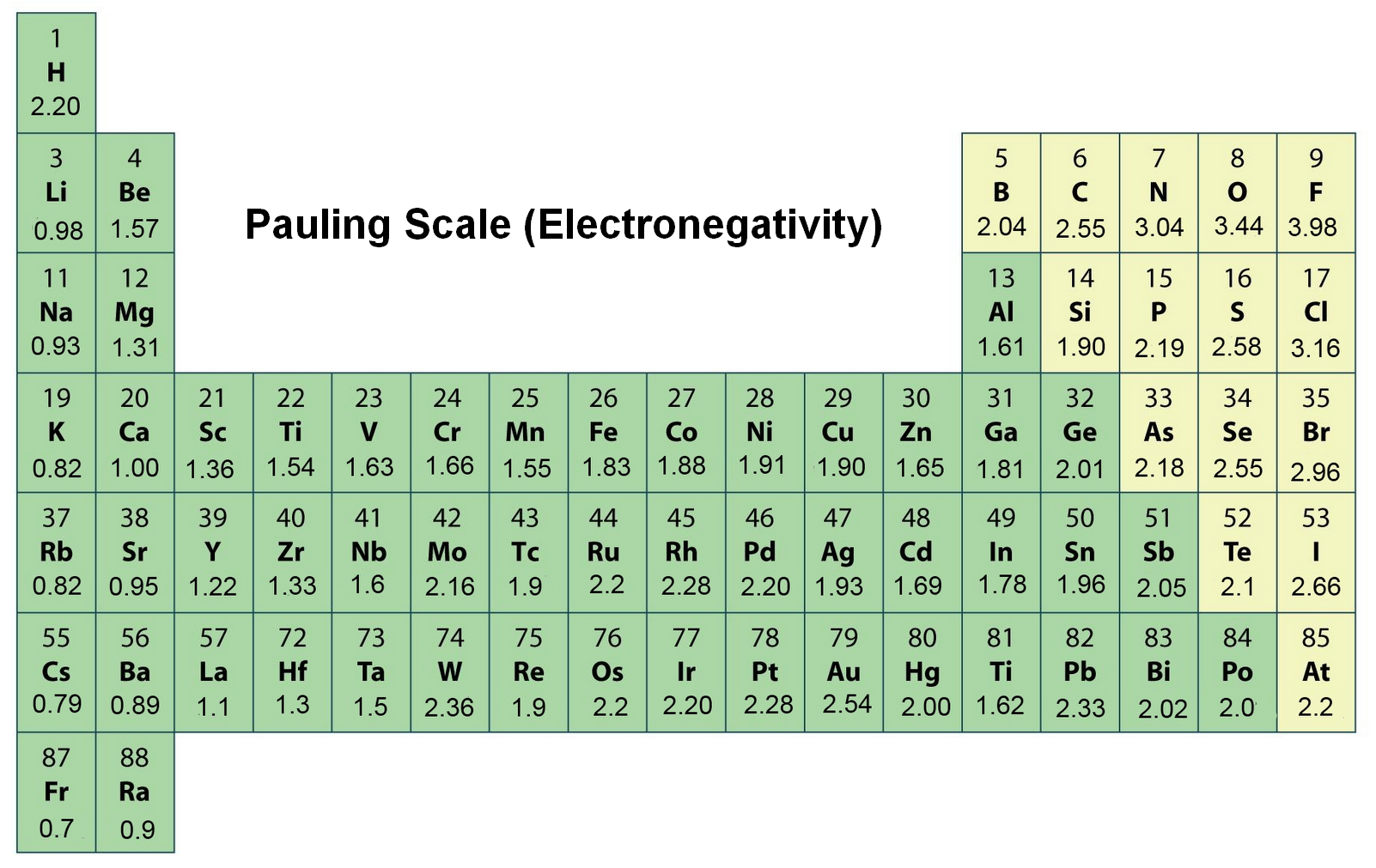
위 그림은 주기율표에 나타낸 폴링의 전기음성도 입니다.
이를 살펴보면 같은 주기에서 원자번호가 증가할수록 전기음성도가 증가하며, 같은 족에서 원자번호가 증가할수록 전기음성도가 감소함을 알 수 있습니다. 이는 아래에서 더 자세히 설명드리겠습니다.
같은 주기에서 전기음성도의 변화
같은 주기에서 원자번호가 증가하면 (왼쪽에서 오른쪽으로 이동하면) 전자껍질의 수는 동일하게 유지되지만 양성자 및 전자의 수는 증가하게 됩니다. 따라서 핵과 전자 사이에는 더 큰 인력이 발생하고(유효 핵전하의 증가) 이로 인해 전기음성도(전자에 대한 핵의 인력)은 증가한다.
같은 족에서 전기음성도의 변화
같은 족에서 원자번호가 증가하면 (위에서 아래로 이동하면) 양성자와 전자의 수 뿐만 아니라 전자껍질의 수 또한 함께 증가합니다. 따라서 내부 전자껍질에서 전자들의 가리움효과(또는 차폐효과, shielding effect)로 인해 전자와 핵 사이의 인력인 전기음성도는 감소합니다.
주기율표에서 볼 수 있는 대각선 관계
주기율표에서 두 번째 및 세 번째 주기에 대각선으로 인접한 원소들 사이에는 아래와 같은 대각선 관계가 존재합니다.

리튬(Li)과 마그네슘(Mg), 베릴륨(Be)과 알루미늄(Al), 붕소(B) 및 실리콘(Si)은 유사한 특성을 갖는다. 붕소 및 실리콘은 모두 반도체로서 작용하는데 이러한 유사성은 전기음성도로 설명할 수 있습니다.
위에서 말씀드렸듯이, 주기율표에서 오른쪽으로 이동하면 전기음성도가 증가한다고 설명드렸습니다. 이를 통해 붕소의 전기 음성도는 베릴륨의 전기음성도보다 큼을 알 수 있습니다.

또한 주기율표에서 아래로 내려오면 전기음성도가 감소한다고 말씀드렸습니다. 즉, 붕소의 아래에 위치한 알루미늄의 전기음성도는 붕소보다 적을 것이라는 것을 알 수 있습니다. 따라서 베릴륨과 알루미늄은 모두 붕소보다 전기음성도가 작지만 서로 유사한 전기음성도와 화학적 특성을 보입니다.
전자친화도(Electron Affinity)의 뜻과 개념
전자친화도(Electron Affinity, EA)의 정의 전자친화도 말 그대로 원소와 전자의 친화도를 나타내는 개념입니다. 전자친화도는 기체 상태의 중성원자가 전자를 받아 음이온을 형성할 때 방출되는 에너지를 측정하..
luvlyday.tistory.com
원자가 결합을 형성하는 이유
원자가 결합을 형성하는 이유 원자는 화학 결합을 형성하여 외부 전자 껍질을 더 안정한 상태로 만듭니다. 원자가 형성하는 화학 결합의 유형은 여러가지가 있지만 항상 원자를 가장 안정하게 �
luvlyday.tistory.com
'화학' 카테고리의 다른 글
| 산화(Oxidation)와 환원(Reduction) (0) | 2020.05.06 |
|---|---|
| 전기음성도와 전자친화도의 차이 (0) | 2020.05.06 |
| 전자친화도(Electron Affinity)의 뜻과 개념 (1) | 2020.04.21 |
| [원자 구조] 원자 반지름의 측정 방법 (0) | 2020.03.17 |
| [원자 구조] 원자 궤도(Orbit)와 오비탈(Orbital)의 이해 (0) | 2020.03.07 |
댓글