화학에서 정의하는 비편재화(Delocalized)된 전자에 대하여
비편재화 된 전자는 임의의 하나의 원자 또는 하나의 공유결합에 속하지 않은 원자(또는 이온이나 분자)의 전자를 뜻합니다.
비편재화된 전자는 고리구조를 가지는 방향족 탄화수소에서 흔히 볼 수 있습니다. 여기서 비편재화된 전자는 단일 또는 이중 결합으로 표시하지 않고 원을 그려 표시합니다. 이러한 표기법은 고리구조 내의 전자가 특정 화학결합에 속하는 것이 아니라 고리구조 내 결합의 어느 곳이든 존재할 가능성이 동등하다는 것을 뜻합니다.
비편재화된 전자는 그 독특한 특성으로 인해 원자, 이온 또는 분자의 전기적 특성을 바꿀 수 있습니다. 대체적으로 비편재화 된 전자가 많은 물질은 높은 전기전도도를 가지는 경우가 많습니다.

고리구조를 가지는 대표적 물질인 벤젠 분자에서, 전자에 대한 전기적 힘은 고리 전체에 걸쳐 균일합니다. 이런 비편재화는 공명 구조를 생성합니다.
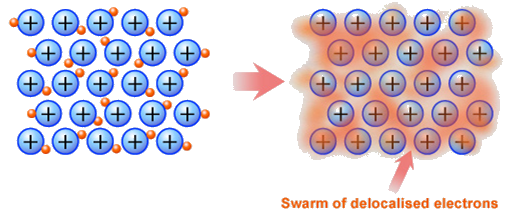
비편재화 된 전자는 방향족 탄화수소 뿐 아니라 고체 금속에서도 볼 수 있습니다. 금속결합을 이루는 전자는 금속 내부를 자유롭게 이동할 수있는 전자의 바다를 형성합니다. 금속의 전기전도도가 우수한 이유는 이런 비편재화된 전자 때문입니다.
[재료공학] 금속결합(metallic bond)의 이해
금속결합(metallic bond)의 정의는? 금속 결합은 금속 원자들을 금속 결정 내에 고정시키는 독특한 결합 방식으로, 공유결합이나 이온결합과는 전혀 다른 유형의 결합입니다. 금속 원자는 전자를 속
luvlyday.tistory.com
같은 탄소원자로 구성된 다이아몬드와 흑연의 비교를 통해 비편재화의 영향을 살펴보겠습니다. 다이아몬드의 결정구조는 사면체를 이루는데 각 모서리의 탄소원자는 모두 총 4개의 공유결합에 참여합니다. 이 전자들은 각 결합에 모두 참여하기 때문에 각 결합위치에만 존재하는, 즉 편재화된 전자라고 할 수 있습니다.
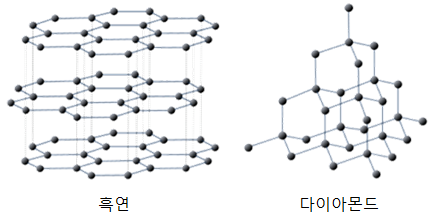
다이아몬드와 마찬가지로 탄소로 구성된 흑연의 경우 다이아몬드와는 달리 탄소원자가 각자 3개씩 다른 탄소원자와 공유결합을 이룹니다. 따라서 각각의 탄소원자는 흑연의 층 사이에 비편재화된 전자를 가지고 있으며 이렇게 비편재화된 원자들은 흑연의 평면을 따라 자유롭게 이동할 수 있습니다. 이런 차이점으로 인해 다이아몬드의 전기 전도도는 매우 낮은 반면 흑연의 전기 전도도는 높습니다.
그래핀(Graphene)에 대하여
그래핀(Graphene)이란 무엇인가? 그래핀(Graphene)을 간단히 요약하면 '단일층의 흑연'이라고 할 수 있습니다. 벌집모양인 육각형의 고리를 가진 탄소의 층이 겹겹이 쌓여 구성된 물질이 바로 흑연(그
luvlyday.tistory.com
'화학' 카테고리의 다른 글
| 가장 무거운 원소는 무엇인가? (0) | 2020.06.02 |
|---|---|
| 질량과 무게의 차이 (1) | 2020.05.30 |
| 온도(Temperature)와 열(Heat)의 차이 (0) | 2020.05.19 |
| 액체 질소(Liquid Nitrogen)에 대하여 (0) | 2020.05.17 |
| 표백제를 먹으면 어떻게 될까요? (0) | 2020.05.16 |

댓글